Elan Eisenmesser博士
副教授

万博手机版下载
博士,普渡大学,1998年
研究生课程会员资格
艾森梅塞尔实验室采用一种独特的方法来理解蛋白质功能,特别是酶的功能,通过利用分子工程方法来控制结构相互作用和构成其构象变化的潜在运动。艾森梅塞尔实验室的最终目标是在原子分辨率和生物水平上充分描述分子相互作用,特别强调可能被利用来阻止或促进潜在疾病进展的医学相关系统。例如,我们利用核磁共振、x射线晶体学和冷冻电镜方法以及生物化学和细胞生物学研究来充分描述分子事件,这些事件是信号传导和细胞稳态中涉及的分子相互作用的基础。我们的方法远远超出了分子复合物的静态描述,包括酶活性位点和调节功能的变构耦合运动中的动态作用。在酶运动方面,我们的研究被认为是“理性地设计酶运动的第一次尝试”(见Peptide Letters, Doucet, 2011),并提供了一种揭示酶运动如何进化以执行特定任务的关键手段。
Eisenmesser实验室目前的重点是如下所述的三个项目,重点是:
- 了解先天免疫的分子事件,在分子和细胞水平上与癌症和炎症活动有关,
- 揭示了细菌和病毒如何破坏先天免疫系统导致感染的分子细节,
- 揭示了在细胞功能和癌症中关键氧化还原调控因子的结构和动态细节。
细胞外部的白介素信号和细胞内部的受体相互作用
白细胞介素:白细胞介素(ILs)是一类主要的细胞因子,负责调节先天免疫反应,它们的解除管制已被证明发生在炎症、癌症和感染期间。Eisenmesser实验室特别专注于了解抗炎白细胞介素(IL-37)利用的信号事件,以调节它们的结构和生物活性,并将其用作潜在的治疗方法。此类研究开始于PI的IL-13博士后工作期间,但后来已扩展到其他白介素,包括IL-8和抗炎白介素,包括IL-37和IL-38。
白细胞介素受体(TIR) dom高温:TIR结构域是在白细胞介素-1家族受体(IL-1Rs)和toll样家族受体中都发现的保守结构域,尽管自它们被发现以来已有20年,但它们的分子相互作用一直没有被直接检测到。Eisenmesser实验室特别专注于了解这些TIR结构域如何在膜表面连接信号与适配器TIR结构域的下游相互作用。虽然我们有兴趣确定在原子分辨率下发生的促炎TIRs(如TLR1/2)的分子相互作用,但我们也有兴趣了解IL-1R家族受体(如包括IL-1R8在内的受体)如何降低炎症。最后,我们也有兴趣了解细菌如何利用自己的TIR结构域通过宿主细胞TIR拟态来控制宿主细胞免疫。
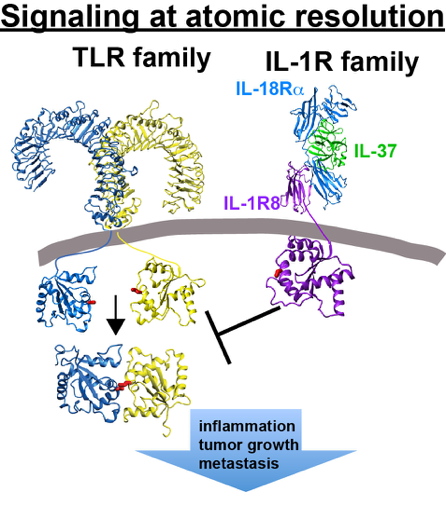
- Kendrick AA, Holliday MJ, Isern NG, Zhang F, Camilloni C, Huynh C, Vendruscolo M,Eisenmesser EZ。“白细胞介素-8的动态及其与人CXC受体I肽的相互作用。”蛋白质科学。(2014) 23(4): 464 - 80。
- 卡沃利,G, Justic, JN, Boyle, KE, D 'Alessandro, A,Eisenmesser EZ, Herrera, JJ, Hansen, KC, Nemkov, T, Stienstra, R, Garlanda, C, Mantovani, A, Seals, DR, Dagna, L, Joosten, LAB, Ballak, DB, Dinarello, CA。”白细胞介素37逆转炎症的代谢成本,增加氧化呼吸和提高运动耐受性pnas(2017) 114(9):2313-2318。
- Eisenmesser EZ, Gottschlich A, Redzic JS, Paukovich N, Nix JC, Azam T, Zhang L, Zhao R, Kieft JS, The E,孟X, Dinarello CA.“白细胞介素-37单体是降低先天免疫的活性形式”。Proc nacad Sci (2019) doi: 10.1073/pnas.1819672116
新型冠状病毒肺炎
冠状病毒(CoVs)是导致最近Covid-19爆发的不断进化的病原体,我们之前研究了包括SARS-CoV-1在内的病毒的多种蛋白质。虽然我们最初的兴趣是多年前来自SARS-CoV-1的核衣壳(N)蛋白,但这些研究使我们的团队能够迅速将我们的研究扩展到来自SARS-CoV-2的多种蛋白质,其中包括其N蛋白。
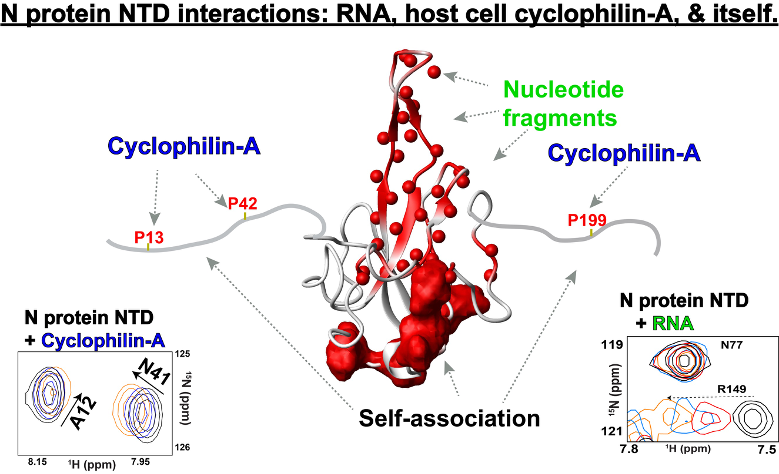
N蛋白是冠状病毒的四种结构蛋白之一,在包装病毒RNA和操纵宿主细胞机制中起着核心作用,但它的动态行为和核苷酸结合中的混乱性使得标准结构方法难以解决其原子分辨率细节。为了开始研究SARS-CoV-2 N蛋白与RNA和宿主细胞蛋白的相互作用,并描述其独特的动态行为,我们使用核磁共振溶液研究了N蛋白及其侧翼区域的折叠N端结构域(NTD)。我们的研究揭示了大量的相互作用,其中包括由紊乱的侧翼区域介导的依赖温度的自我关联,这些区域也作为宿主细胞亲环蛋白a的结合位点。相比之下,核苷酸结合主要是由中央折叠的NTD核心介导的。这项工作最有趣的方面是,人类亲环蛋白a在10年前就已经被发现可以通过N蛋白增加冠状病毒的病毒复制;然而,目前还不存在已知的机制。我们的研究确定了宿主细胞亲环蛋白a在介导N蛋白自关联中的潜在机制,已知它可以调节负责病毒复制的细胞冷凝物。总的来说,我们的研究已经开始揭示核衣壳蛋白动力学的复杂性及其与生物靶标的首选相互作用位点。
- 克拉克森MW,雷M,Eisenmesser EZ李国强,李国强,李国强,“利用核磁共振场循环测量SARS核衣壳的介动力学”。核磁共振(2009)45:17 -225。
- Schultz JS, McCarthy MK, Rester C, Sabourin KR, Annen K, DomBourian M,Eisenmesser EZ,弗雷泽-阿贝尔A,奈特V,杰尼施T,莫里森TE,罗奇福德R,凯德尔RM。“开发和验证使用干燥血点检测SARS-CoV-2血清流行率的多重微球免疫测定方法:应用于美国科罗拉多州的急救人员。”J.临床微生物。(2021) 61(5): 1586 - 1599。Doi: 10.1128 / JCM.00290-21。
- Redzic JS, Lee E, Born A, issaan A, Henen MA, Nichols P, Blue A, Hansen KC, D'Alessandro A, Vögeli B,Eisenmesser EZ.“SARS-CoV-2核衣壳n端区域的内在动力学和相互作用位点”。JMB (2021) Doi:10.1015/j.jmb.2021.167108。
细菌/主机接口
我们对人类感染和开发专门阻止感染的策略的兴趣,促进了我们努力了解细菌如何破坏我们最初的免疫反应。CryoEM和NMR研究的重点是确定具有多个结构域的巨型蛋白酶的分子机制,如肺炎链球菌IgA1蛋白酶(IgA1P)。这些IgA1P代表了一系列不同的毒性因子,是趋同进化的例子,因为它们的IgA1P区域是金属蛋白酶、丝氨酸蛋白酶和半胱氨酸蛋白酶。来自不同致病菌的许多IgA1P除了其IgA1P区域外,还包含其他功能未知的结构域。例如,我们已经通过核磁共振解决了IgA1P的小G5结构域的结构,开始识别其配体。然而,我们的中心重点是使用cryoEM来阐明它们IgA1P区域的原子分辨率细节,正如我们最近阐明的~1300个肺炎链球菌IgA1P残留及其IgA1底物催化过程,表明了活性位点打开(或“门控”)的“pakman”样机制。
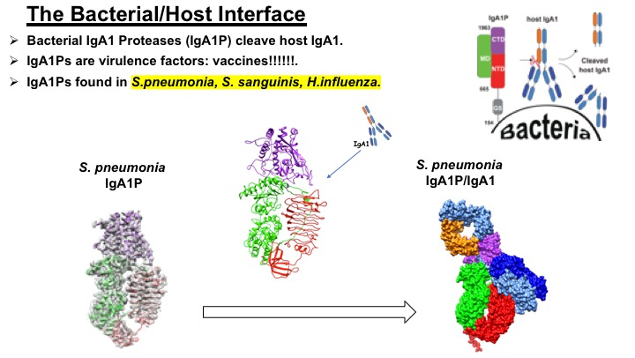
- Chi YC, Rahkola JT, Kendrick AA, Holliday MJ, Paukovich N, Roberts TS, Janoff EN,Eisenmesser EZ.肺炎链球菌IgA1蛋白酶:一种金属蛋白酶,可在体外催化分裂方式。蛋白质科学。(2017) 26 (3): 600 - 610.
- Paukovich N,雷季奇J,奇YC,拉科拉JT,伊赛安A,布鲁A,汉森KC,Janoff EN,Eisenmesser EZ.“链球菌肺炎G5结构域结合不同的配体《蛋白质科学》。(2019) 28(10):1797-1805.
- 王震,Rahkola J, Janoff J, Redzic JS, Chi Y-C, Tran N, Holyoak T,郑华,Eisenmesser EZ.“肺炎链球菌IgA1蛋白酶的作用机制及抑制”。自然通讯(2020)11(1):6063-6070(也作为编辑重点https://www.nature.com/collections/hhfigaahch)。
蛋白质动力学与功能
我们在蛋白质动力学领域做出了几项重大贡献,这些贡献对理解蛋白质功能、变构有直接影响,现在使我们能够以合理的方式设计酶动力学。艾森梅塞尔实验室对结构和动力学之间的相互作用特别感兴趣,这些相互作用是酶构象重排的基础,以指导它们的功能。我们最近的研究集中在负责调节细胞氧化还原的关键黄素还原酶家族,称为胆绿素还原酶B (BLVRB),这是如此重要,以至于它们控制着细胞的命运。我们已经发现,在人类BLVRB的活性位点,酶动力学调节功能高达25埃,但我们专注于结合核磁共振和x射线晶体学,以确定整体运动如何调节整个家族的功能,以及这些运动是如何进化的。这些研究揭示了辅酶调控的新机制,揭示了辅酶的释放是限制速率的步骤,单氢化物调节了整体的动态和结构。

- Eisenmesser张峰,张峰,张峰。”克里米亚-刚果出血热病毒蛋白酶内的内在动态定位于与底物相互作用相同的区域。《蛋白质科学》(2015)24(5): 651 - 60。
- 霍利迪乔丹,C,阿姆斯特朗GS, Eisenmesser易之。多亲环蛋白家族成员间全催化循环的测定及CPMG-RD在可逆催化体系中应用的局限性生物化学(2015)54(38):5815-27。
- 霍利迪乔丹,Camilloni C,阿姆斯特朗GS,Vendruscolo M。Eisenmesser EZ。动态变构网络调节酶的功能结构科学,2017,25(2):276-286。
- 鲍科维奇N,薛m, Elder JR,雷季奇JS,布鲁A,派克H,米勒BG,皮茨TM,波洛克DD,汉森K,达历山德罗A,Eisenmesser EZ.“胆绿素还原酶B动态与辅酶结合耦合”中华分子生物学杂志(2018)430(18 Pt B):3234-3250。
- Duff M, Redzic JS, Ryan LP, Paukovich N, Zhao R, Nix JC, Pitts TM, Agarwal P,Eisenmesser EZ.进化变化BLVRB家族的结构、动力学和功能。J.Biochem。(2020) 168(2): 191 - 202。
- 雷季奇JR,达夫M,布鲁A,皮茨T,阿加瓦尔P,Eisenmesser EZ.“通过胆绿素还原酶B内的动态变构调节酶功能”。分子生物前沿,8:691208。Doi: 10.3389 / fmolb.2021.691208。
额外的研究
生物化学与分子遗传系的合作环境促进了许多合作,其中包括郑宏仁博士,Kirk Hansen博士,Angelo D 'Alessandro博士,赵睿博士,Jeff Kieft博士和James DeGregori博士。例如,与D’alessandro实验室合作的多个正在进行的项目专注于由酶控制的关键代谢相互作用,我们专注于生产这些酶,以确定控制其功能的原子分辨率细节。

| 图片 | 第一个名字 | 姓 | 职称 | 电子邮件 |
|---|---|---|---|---|
 |
罗瑞拉 | Alamillo | 研究生 | lorena.alamillo@www.dc-118.com
|
| EunJeong | 李 | 博士后学者 | ||
 |
芭芭拉 | Marcolin | 专业研究助理 | barbara.marcolin@www.dc-118.com |
 |
嘉斯米娜 | Redzic | 研究助理 | jasmina.redzic@www.dc-118.com |
白介素和TIR结构域
- Kendrick AA, Holliday MJ, Isern NG, Zhang F, Camilloni C, Huynh C, Vendruscolo M, Eisenmesser EZ。“白细胞介素-8的动态及其与人CXC受体I肽的相互作用。”蛋白质科学。(2014) 23(4): 464 - 80。
- Cavalli, G, Justic, JN, Boyle, KE, D 'Alessandro, A, Eisenmesser EZ, Herrera, JJ, Hansen, KC, Nemkov, T, Stienstra, R, Garlanda, C, Mantovani, A, Seals, DR, Dagna, L, Joosten, LAB, Ballak, DB, Dinarello, CA.“白细胞介素37逆转炎症的代谢成本,增加氧化呼吸,提高运动耐受性。”Pnas, 2017, 114(9):2313-2318。
- Eisenmesser EZ, Gottschlich A, Redzic JS, Paukovich N, Nix JC, Azam T, Zhang L, Zhao R, Kieft JS, The E,孟X, Dinarello CA.“白细胞介素-37单体是降低先天免疫的活性形式”。Proc nacad Sci (2019) doi: 10.1073/pnas.1819672116。
细菌感染
- Chi YC, Rahkola JT, Kendrick AA, Holliday MJ, Paukovich N, Roberts TS, Janoff EN, Eisenmesser EZ。肺炎链球菌IgA1蛋白酶:一种金属蛋白酶,可在体外催化分裂方式。蛋白质科学。(2017) 26(3): 600 - 610。
- 波科维奇N,雷季奇J,奇YC,拉科拉JT,伊赛安A,布鲁A,汉森KC,雅诺夫EN,艾森梅塞尔EZ。肺炎链球菌G5结构域结合不同的配体。蛋白质科学。(2019) 28日(10):1797 - 1805。
蛋白质动力学与功能
- Eisenmesser EZ, Capodagli GC, Armstrong GS, Holliday MJ, Isern NG, Zhang F, Pegan SD。”克里米亚-刚果出血热病毒蛋白酶内的内在动态定位于与底物相互作用相同的区域。蛋白质科学(2015)24(5):651-60。
- 霍利迪·MJ, C,阿姆斯特朗GS,艾森梅塞尔EZ。多亲环蛋白家族成员间全催化循环的测定及CPMG-RD在可逆催化体系中应用的局限性生物化学(2015)54(38):5815-27。
- Holliday MJ, Camilloni C, Armstrong GS, Vendruscolo M, Eisenmesser EZ。动态变构网络调节酶的功能结构科学,2017,25(2):276-286。
- Paukovich N, Xue M, Elder JR, Redzic JS, Blue A, Pike H, Miller BG, Pitts TM, Pollock DD, Hansen K, D 'alessandro A, Eisenmesser EZ。“胆绿素还原酶B动态与辅酶结合耦合”中华分子生物学杂志(2018)430(18 Pt B):3234-3250。